Nessuno mangia solo
Maria Cristina Thaller
Università di Roma “Tor Vergata”
Neppure un eremita, nel bel mezzo di un’area desolata dovenon ci siano altri esseri visibili, mangia solo: divide il suo pasto con le migliaia di miliardi* di batteri commensali che vivono nel nostro intestino.
In passato, il termine commensale, sottintendeva più che altro un’interazione quasi casuale: si pensava che questi particolari batteri, non patogeni, si limitassero a sfruttare le componenti non digerite del nostro cibo, e che la loro presenza fosse tollerata e quasi indifferente per l’ospite.
 Nel corso degli ultimi anni, tuttavia, questa interpretazione si è rivelata semplicistica e stiamo appena iniziando a intravedere la complessità dell’interazione e l’importanza delle sue implicazioni. Gli animali hanno avuto origine in un mondo dominato dai batteri e l’associazione uomo- microrganismi è frutto di una coevoluzione durante la quale sono stati messe a punto strategie di adattamento reciproche, vantaggiose per tutti i contraenti.
Nel corso degli ultimi anni, tuttavia, questa interpretazione si è rivelata semplicistica e stiamo appena iniziando a intravedere la complessità dell’interazione e l’importanza delle sue implicazioni. Gli animali hanno avuto origine in un mondo dominato dai batteri e l’associazione uomo- microrganismi è frutto di una coevoluzione durante la quale sono stati messe a punto strategie di adattamento reciproche, vantaggiose per tutti i contraenti.
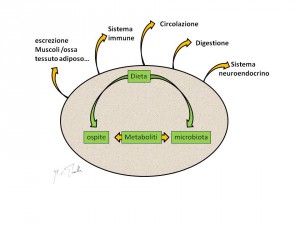
Per la loro quantità e varietà i commensali sono considerati nel loro insieme, con il termine “microbiota”. L’intestino, dove la diversità microbica è altissima e l’epitelio relativamente permeabile, è sicuramente il principale luogo di scambio tra noi e i nostri commensali; l’influenza che l’attività del microbiota intestinale ha su di noi è tale che circa un terzo del metaboliti che circolano nel nostro sangue è di origine microbica (fig. 2)
Tra questi metaboliti alcuni fungono da segnale tra il microbiota e l’ospite e viceversa, influenzando non solo il funzionamento di diversi sistemi ma anche il nostro comportamento. E’ evidente, quindi, come sia importante arrivare a conoscere il microbiota e comprendere le molteplici conseguenze della sua interazione con noi tra cui, oltre alla digestione di composti complessi, che rende disponibile energia per le nostre cellule (sotto forma di acidi grassi volatili, specialmente ac. butirrico) vanno ricordati la trasformazione di alcuni nostri metaboliti (anche con produzione di sostanze tossiche) e/o di farmaci, e il contributo allo sviluppo e mantenimento del sistema immune. Con la sua presenza, infatti, il microbiota permette all’organismo di imparare a distinguere i microrganismi potenzialmente pericolosi, contro i quali reagire, dagli innocui commensali per i quali si sviluppa uno stato di tolleranza, che previene l’insorgere di infiammazioni croniche.
I primi tentativi di stabilire quali fossero le specie microbiche associate al nostro intestino, non hanno dato risultati chiari. L’enorme varietà di specie microbiche esistenti, confondeva il quadro generale, dando l’impressione che non esistesse alcuno schema per l’interazione tra microbiota intestinale e ospite umano, e che ogni singolo individuo albergasse una comunità microbica diversa da quella di tutti gli altri. In realtà gli studi sul DNA estratto dall’intera comunità microbica (metagenoma), hanno permesso di capire che la struttura del microbiota intestinale è relativamente costante e se ne possono distinguere tre tipi principali, di cui due più frequenti del terzo. Per riuscire a individuare lo schema è necessario considerare i phylum evolutivi (come studiare gli “europei” e non la famiglia X o quella Y). Mediamente, in associazione con noi ci deve essere una buona quantità di Bacteroidetes, una certa quota di Firmicutes (specialmente “Clostridia”) e un pizzico di Actinomycetes (specialmente Bifidobacteria). E’ un po’ come comporre una squadra formata da muratori, falegnami, idraulici etc.; le caratteristiche precise dei singoli artigiani non sono essenziali. La variabilità all’interno di ogni phylum garantisce un equilibrio dinamico in cui la composizione resta stabile anche se la percentuale relativa dei diversi gruppi o delle specie all’interno di ciascun gruppo, può variare, seguendo le fluttuazioni dei fattori ambientali e di ospite.
Figura 2
 La colonizzazione dell’intestino, sterile durante la vita intrauterina, inizia alla nascita, da parte di batteri provenienti soprattutto dalla madre: dalla mucosa vaginale nel caso di parti fisiologici, dalla cute nel caso di un parto cesareo. La colonizzazione da parte delle specie giuste, è poi favorita dalla presenza, nel latte materno, di oligosaccaridi esclusivi che ne facilitano l’attecchimento e che sono assenti nel latte degli altri mammiferi. Nei neonati allattati al seno, infatti, i Bifidobacteria sono quasi il 90% del microbiota del colon. Nella prima infanzia la struttura del microbiota non è stabilizzata e il sistema immunitario è ancora in via di sviluppo, in questo periodo l’ospite è più esposto alle gastroenteriti: questo spiega l’estrema cura che va posta nell’alimentazione dei bambini sotto i due anni.
La colonizzazione dell’intestino, sterile durante la vita intrauterina, inizia alla nascita, da parte di batteri provenienti soprattutto dalla madre: dalla mucosa vaginale nel caso di parti fisiologici, dalla cute nel caso di un parto cesareo. La colonizzazione da parte delle specie giuste, è poi favorita dalla presenza, nel latte materno, di oligosaccaridi esclusivi che ne facilitano l’attecchimento e che sono assenti nel latte degli altri mammiferi. Nei neonati allattati al seno, infatti, i Bifidobacteria sono quasi il 90% del microbiota del colon. Nella prima infanzia la struttura del microbiota non è stabilizzata e il sistema immunitario è ancora in via di sviluppo, in questo periodo l’ospite è più esposto alle gastroenteriti: questo spiega l’estrema cura che va posta nell’alimentazione dei bambini sotto i due anni.
Durante la crescita, le modificazioni fisiologiche e di alimentazione portano a una diminuzione dei Bifidobacteria e a un aumento di Clostridia e Bacteriodetes e la struttura del microbiota tende a mantenersi stabile se non esposta a fattori di disturbo eccezionali. In corrispondenza di un’età soglia individuale, il microbiota invecchia e torna ad essere poco stabile.
L’alimentazione ha un ruolo determinante per la struttura del microbiota che risponde ai composti disponibili come nutrimento; la consapevolezza dell’interazione con il microbiota rende ancora più evidente il vantaggio di un’alimentazione variata: una dieta monotona favorisce solo alcuni microrganismi, e può causare l’accumulo di sostanze tossiche o un eccesso di acido butirrico che facilita l’obesità. Naturalmente anche la qualità del cibo influenza l’equilibrio del microbiota intestinale: il valore dei cibi naturali e freschi, non risiede solo nella presenza di principi alimentari facilmente deperibili e nell’assenza dei pesticidi e/o farmaci impiegati nelle colture o negli allevamenti intensivi, ma anche nella mancanza di additivi e conservanti, aggiunti agli alimenti per garantirne una maggiore durata. Un eccesso di alimenti contenenti queste sostanze può aver effetto anche sul microbiota, spostandone gli equilibri. Anche le terapie a base di antibiotici, naturalmente, possono alterare i rapporti tra le componenti del microbiota intestinale, con possibili effetti a largo spettro sui rapporti microbiota/ospite, specialmente nei periodi di instabilità: l’eliminazione di alcuni microrganismi, infatti, può portare alla scomparsa di altri che ne dipendono, o all’espansione di terzi che ne sarebbero invece stati limitati. Fortunatamente, il microbiota è relativamente stabile e torna facilmente allo stato precedente; in qualche caso, tuttavia, l’alterazione può perdurare e avere ricadute sulla salute dell’ospite. In questi casi può essere utile l’assunzione di batteri definiti probiotici, appartenenti a specie che risiedono abitualmente nell’intestino e che svolgono un’azione benefica. Tra questi i lattobacilli, presenti anche nei derivati fermentati del latte, sono i più comuni.
Gli studi sul microbiota intestinale, spiegano il successo di abitudini basate su osservazioni empiriche. L’uso di purgare i bambini al cambio di stagione, in una società dove con la stagione cambiava necessariamente anche l’alimentazione, facilitava l’attecchimento delle specie microbiche ingerite con le primizie, migliorando l’efficienza dei processi digestivi.
La diminuzione degli effetti collaterali del massiccio consumo di legumi, ottenuta con l’uso del passaverdure, ha la sua spiegazione scientifica nell’allontanamento delle bucce, ricche di raffinosio. Il raffinosio è uno zucchero indigeribile per noi: arriva intatto ai batteri del colon che lo fermentano con abbondante produzione di gas. Naturalmente, usare il frullatore non solo non ottiene lo stesso vantaggio, ma peggiora la situazione frammentando le bucce e aumentando la superficie disponibile all’attacco microbico.
Ricordarsi che non siamo mai soli, quando mangiamo, e cercare di mantenere un buon equilibrio del microbiota prestando attenzione all’alimentazione, può quindi favorire grandemente il nostro benessere e il nostro stato di salute
Letture di approfondimento/ Further reading
Harris K., Kassis A., Major G., and Chou C.J. 2012 Is the Gut Microbiota a New Factor Contributing to Obesity and Its Metabolic Disorders? Journal of Obesity Article ID 879151 doi:10.1155/2012/879151. [Articolo]
Heijtz R.D. Wang S., Anuar F., Qian Y., Björkholm B. , Samuelsson A. , Hibberd M.L., Forssberg H.and Pettersson S. 2011. Normal gut microbiota modulates brain development and behavior. Proc Natl Acad Sci U S A. Feb 15;108(7):3047-3052. [Articolo]
Jeffery I. B., and O’Toole P. W., 2013 Diet-Microbiota Interactions and Their Implications for Healthy Living. Nutrients. 2013, 5: 234–252. [Articolo]
O’Hara A.M. & Shanahan F., 2006. The gut flora as a forgotten organ. EMBO reports, 7: 688-693.[Articolo]




Università di Tor Vergata