RICOSTRUZIONE DELLA PALEODIETA ![]()
Dr. Roberta Lelli,
Centro di Antropologia molecolare per lo studio del DNA antico, Dipartimento di Biologia, Università di Roma “Tor Vergata”
ABSTRACT
“L’uomo è ciò che mangia” (Ludwig Feuerbach, 1862): ricostruzione della dieta delle popolazioni del passato attraverso l’analisi degli isotopi stabili del carbonio e dell’azoto del collagene osseo
A partire dal 1977 (Vogel and van der Merwe), l’applicazione dello studio degli isotopi stabili del carbonio e dell’azoto a questioni archeologiche è stata ampiamente impiegata per ricostruire aspetti di eventi preistorici come l’alimentazione delle popolazioni del passato (paleodieta).
La ricostruzione isotopica della paleodieta è basata su due assunzioni: la prima è che la composizione isotopica del collagene osseo, il principale componente della matrice organica dell’osso, riflette perlopiù la composizione isotopica degli alimenti consumati nel corso della vita; la seconda è che i vari alimenti presentano distinte firme isotopiche permettendo così di risalire al tipo di alimento che le ha prodotte (DeNiro 1985; Hedges 2006). Pertanto questa analisi consente di fornire indicazioni sull’alimentazione di un individuo 10-15 anni prima della sua morte dato il basso tasso di rimodellamento del collagene osseo.
Le firme isotopiche riflettono la componente proteica della dieta: l’azoto si assume derivi esclusivamente dalle proteine mentre il carbonio oltre che dalle proteine potrebbe derivare anche da altre fonti come lipidi e carboidrati, in particolare quando la dieta è caratterizzata da un basso apporto proteico.
Il carbonio e l’azoto possono esistere in due forme isotopiche stabili:
-12C e 13C, le cui abbondanze sono rispettivamente 98.89% e 1.11%;
-14N e 15N, le cui abbondanze sono rispettivamente 99.63% e 0.37%.
La composizione isotopica di un organismo è misurata come il rapporto dell’isotopo pesante su quello leggero; poichè l‘abbondanza dell’isotopo leggero supera di gran lunga quella dell’isotopo pesante questo rapporto è espresso da un numero molto piccolo. Per rendere tale valore più utilizzabile, le misure isotopiche sono riportate con la notazione delta (δ; cioè la deviazione del rapporto isotopico nel campione esaminato da quello rilevato in un materiale assunto come standard) ed espresse in parti per mille (‰):
δ (‰) = [(Rcampione / Rstandard) – 1] * 1000
dove R è il rapporto tra l’isotopo pesante e quello leggero.
Per il carbonio e l’azoto, le diciture “δ13C” e “δ15N” si riferiscono rispettivamente ai rapporti 13C/12C e 15N/14N in relazione a standard specifici.
Per il carbonio il materiale di riferimento è la Pedee belemnite (PDB), una dolomite fossile il cui rapporto 13C/12C è inusualmente alto sicchè i valori di δ13C nella maggiorparte degli organismi sono negativi.
Per l’azoto lo standard è l’azoto atmosferico; nella maggiorparte degli organismi i valori di δ15N sono più alti di quello dello standard e di conseguenza positivi.
La capacità di distinguere tra le differenti fonti di cibo sulla base dei diversi valori di δ13C e δ15N è legato al fenomeno del frazionamento isotopico, ossia la variazione in abbondanza degli isotopi di un elemento a seguito di processi fisici e chimici.
Frazionamento del carbonio
In natura il principale processo responsabile del frazionamento del carbonio è la fotosintesi.
Sulla base dei due diversi patterns fotosintetici caratteristici delle piante terrestri (classificate come C3 e C4), la fissazione dell’anidride carbonica produce un frazionamento caratteristico che si traduce in valori distinti di δ13C. Questi ultimi in entrambi i tipi di piante risultano essere più bassi rispetto a quello dell’anidride carbonica (~ -7‰): ciò implica che durante la fotosintesi c’è un accumulo preferenziale dell’isotopo leggero (12C) a discapito di quello pesante (13C).
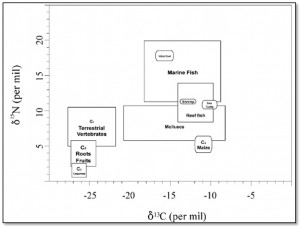
Le piante C3 (quelle delle regioni temperate) sintetizzano un composto a tre atomi di carbonio sulla base del ciclo di Calvin-Benson e presentano un valore medio di δ13C pari a -26.5‰. Le piante degli ambienti caldi e aridi, classificate come C4, sintetizzano un composto a 4 atomi di carbonio sulla base del ciclo di Hatch-Slack e hanno un valore medio di δ13C pari a -12.5‰. I valori più bassi rilevati nelle piante C3 rispetto alle C4 implicano che nelle prime vi è una maggiore discriminazione dell’isotopo pesante che si traduce in una maggiore perdita di 13C nel corso dei processi metabolici.
Quando le piante vengono ingerite dagli animali, i rapporti isotopici del carbonio relativi alle piante vengono incorporati nel collagene osseo dei consumatori. Ciò implica un processo di frazionamento che porta ad un arricchimento in 13C (cioè a valori di δ13C più positivi) di circa il 5‰ rispetto alla dieta; un tale arricchimento legato al livello trofico si verifica tra i produttori e i consumatori primari (erbivori) mentre un arricchimento più esiguo (~ +1‰) viene osservato nei livelli successivi della catena trofica.
Gli isotopi stabili del carbonio sono utili non solo per distinguere il consumo di piante C3 da quello delle C4 ma anche per dicriminare tra una dieta terrestre e una marina. Il carbonio in ambiente marino deriva principalmente dai bicarbonati disciolti che presentano un valore isotopico pari a circa lo 0‰ e quindi sono più ricchi in 13C (di circa il 7‰) rispetto all’anidride carbonica atmosferica; questa differenza è mantenuta ad ogni livello trofico di entrambe le catene alimentari e implica che gli organismi marini mostrino valori di δ13C più alti di quelli terrestri e compresi tra -18 e -10‰.
Un’altra importante risorsa acquatica è il pesce di acqua dolce (lacustre e fluviale). Esso mostra valori di δ13C più bassi rispetto agli organismi marini, cioè più simili a quelli terrestri, ed estremamente variabili. Questo potrebbe essere dovuto a una forte influenza dell’ambiente circostante e di conseguenza all’interazione dei bicarbonati disciolti nelle acque dolci con altre fonti di carbonio: l’anidride carbonica atmosferica, i bicarbonati presenti nel suolo e derivati dal disgregamento roccioso, il carbonio organico derivato dai processi di decomposizione.
Frazionamento dell’azoto
Sebbene questo elemento componga la gran parte dell’atmosfera terrestre (circa il 78%), la maggiorparte degli organismi non possono usare l’azoto in forma gassosa. L’azoto atmosferico deve essere convertito in forme più utilizzabili tramite una serie di processi biochimici del suolo che influenzano il frazionamento dell’azoto e di conseguenza i valori di δ15N nell’ambiente.
Le piante terrestri possono essere distinte in due gruppi sulla base della fonte di idrogeno. Il primo include le piante che fissano l’azoto (come le leguminose); esse hanno una relazione simbiotica con batteri appartenenti al genere Rhyzobium che crescono nelle radici di tali piante dove fissano l’azoto in forma di ammonio. Poichè queste piante non sono dipendenti dal suolo per l’apporto di azoto i loro valori di δ15N sono molto bassi e pari in media all’1‰.
Le piante che non fissano l’azoto appartengono al secondo gruppo; esse assorbono dal suolo azoto già fissato nella forma di ammonio e nitrati presentando valori di δ15N più alti pari in media al 6‰.
In ambiente marino, le piante utilizzano i nitrati disciolti che sono più arricchiti in 15N rispetto alle fonti terrestri di azoto; questa differenza viene mantenuta quando si sale lungo la catena alimentare di entrambe le reti trofiche. Inoltre la catena marina tende a essere più lunga di quella terrestre. Tutto ciò implica che gli organismi marini mostrino valori di δ15N più elevati di quelli terrestri. I rapporti isotopici negli ambienti di acqua dolce sono arricchiti in 15N tanto quanto quelli marini e mostrano una grande variabilità legata al mescolamento di materiale acquatico e terrestre. Pertanto, come gli isotopi stabili del carbonio, anche quelli dell’azoto sono utili per differenziare le fonti alimentari terrestri e acquatiche (marine e di acqua dolce).
Tuttavia la maggiore utilità degli isotopi dell’azoto è quella di individuare le relazioni trofiche: salendo lungo la catena alimentare è stato osservato un costante incremento dei valori di δ15N di circa il 3-5‰ che è probabilmente associato a una maggiore escrezione di 14N sottoforma di urea (ambiente terrestre) o ammonio (ambiente marino) e di conseguenza all’utilizzo preferenziale di 15N nella sintesi dei tessuti.
Plot dei valori isotopici del carbonio e dell’azoto per diverse classi di alimenti (Tykot 2004)
BIBLIOGRAFIA
DeNiro MJ. 1985. Postmortem preservation and alteration of in vivo bone collagen isotope ratios in relation to palaeodietary reconstruction. Nature 317, 806-809.
Hedges REM. 2006. Where does our protein carbon come from? Brit. J. Nutr. 95, 1031-1032.
Tykot RH. 2004. Stable isotopes and diet: you are what you eat. In: M Martini, M Milazzo and M Piacentini (eds), Proceedings of the International School of Physics “Enrico Fermi”, Course CLIV, IOS Press, Amsterdam.
Vogel JC and van der Merwe NJ. 1977. Isotopic evidence for early maize cultivation in New York State. Am. Antiq. 42, 238-242.





Università di Tor Vergata